・炭酸塩鉱物中の炭酸基は溶ける時に二酸化炭素(CO2) となり発泡する(なお,マグネシウムの炭酸塩(菱苦土鉱:マグネサイト)はやや溶けにくく,少し温めた希塩酸に徐々に溶ける)。
・リン酸塩鉱物,ヒ酸塩鉱物,ホ ウ酸塩鉱物,硫酸塩鉱 物などは溶ける場合,泡を出さずに徐々に溶ける。
 |
 |
| 緑色皮膜状の孔雀石とブロシャン銅鉱は似ているが,孔雀石は希塩酸で発泡する。 |
青色皮膜状の藍銅 鉱と青鉛鉱は似ているが,藍銅鉱は希塩酸で発泡し,青鉛鉱は発泡せずに白くなる。 |
-----------------------------------
硫化鉱物(金属元素や亜金属元素とイオウとの化合物) やケイ酸塩鉱物(ケイ酸基を有する)などにも希塩酸で溶けるものがある。
・硫化鉱物が溶けるとき には成分中のイオウが硫化水素(H2S)となり,その溶液は卵腐臭がする。アラバンダ鉱(硫化マンガン)の場合は硫化水素が泡とな ることもある。
・ケイ酸塩鉱物は成分中にアルミニウムを多く含むものは溶けにくく,ナトリウム・カリウム・水 が多く含まれているものは溶けやすい傾向がある。溶けるときには成分中のケイ酸がケイ酸ゲル(無色のゼラチン状)となって分離する。
-----------------------------------
※この試験 は鉱物の1〜3mm程度の小片をスライドグラスに載せ,それ に希塩酸(通常は2規定(N)のものを用いる)を1〜2滴加えて観察する(※顔を近づけないこと)。
方解石(炭酸カルシウム/CaCO3)
の場合
CaCO3 + 2HCl → Ca2+ + 2Cl−
+ H2O + CO2↑方解石 塩酸 塩化カルシウム溶液 水 二酸化炭素
(泡)
・激しく二酸化炭素の泡を出しながら溶けていく。
・塩酸は塩化カルシウム溶液(Ca2+,Cl−)となり,カルシウムの炎色反応(橙色)を示す。
---------------------------------------
※ほかに炭酸カルシウムからなる鉱物にはあられ石もあり,これも方解石と同じ反応を示す。

苦灰石(ドロマイ
ト)(カルシウムとマグネシウムの炭酸塩/CaMg(CO3)2)の
場合
CaMg(CO3)2 +
4HCl → Ca2+ + Mg2+ +
4Cl− + 2H2O + 2CO2↑苦灰石 塩酸 塩化カルシウム・塩化マグネシウム溶液 水 二酸化炭素
(泡)
・上の方解石の場合に比べ,やや溶けにくく,おだやかに 発泡する。
・塩酸は塩化カルシウムと塩化マグネシウムの混合溶液(Ca2+,Mg2 +,Cl−)となり,カルシウムの炎色反応(橙色)を示す。
---------------------------------- -----
※菱苦土鉱(マグネサイト)(炭酸マグネシウム/MgCO3)の場合は塩酸を加温しないと溶けない。下式のように溶け,塩酸は塩化マグネシウム溶液となり,炎色反応は示さない。
MgCO3 + 2HCl → Mg2+ + 2Cl− + H2O + CO2↑
菱苦土鉱 塩酸 加温 塩化マグネシウム溶液 水 二酸化炭素
(泡)

白鉛鉱(炭酸鉛/PbCO3)の場合
PbCO3 + 2HCl → PbCl2 + H2O + CO2↑
白鉛鉱 塩酸 塩化鉛 水 二酸化炭素
(厚い白色被膜) (泡)
・ゆっくり発泡しつつ,急速に塩化鉛の白色不透明の厚い被膜に覆われ る。この塩化鉛は試験管に移し,少量の水を加え,加熱する と溶けるが,冷えると再び白濁状で析出する。
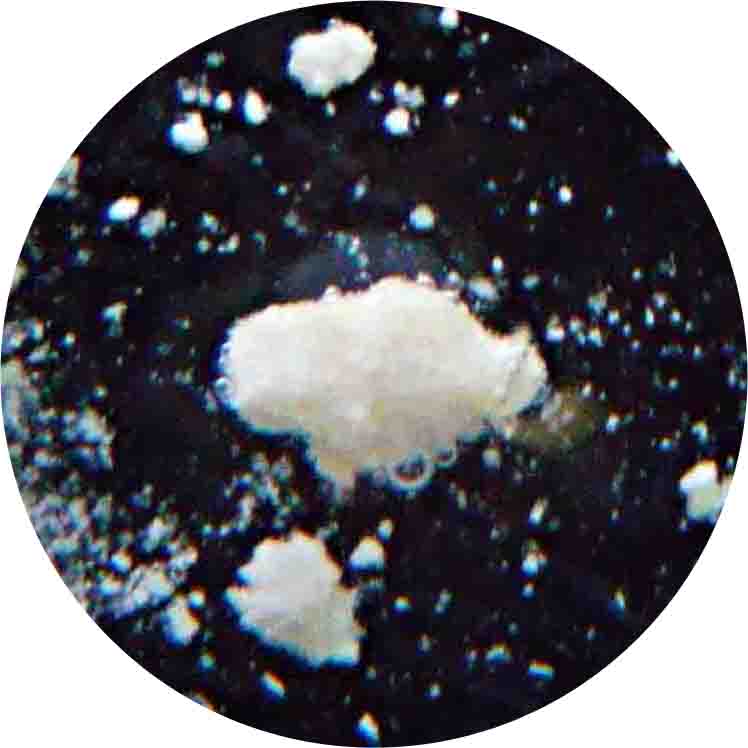
孔雀石(炭酸銅/Cu2(CO3)(OH)2)の場合
Cu2(CO3)(OH)2 + 4HCl → 2Cu2+ + 4Cl- + 3H2O + CO2↑
孔雀石 塩酸 塩化銅溶液(緑色) 水 二酸化炭素
(泡)
・ゆっくり発泡しつつ,徐々に周囲が塩化銅の緑色溶液になっていく(※理科の化学 実験で用いる塩化銅水溶液はこれに比べ濃度が低いので青色である)。 これは銅の炎色反応(緑)を示す。
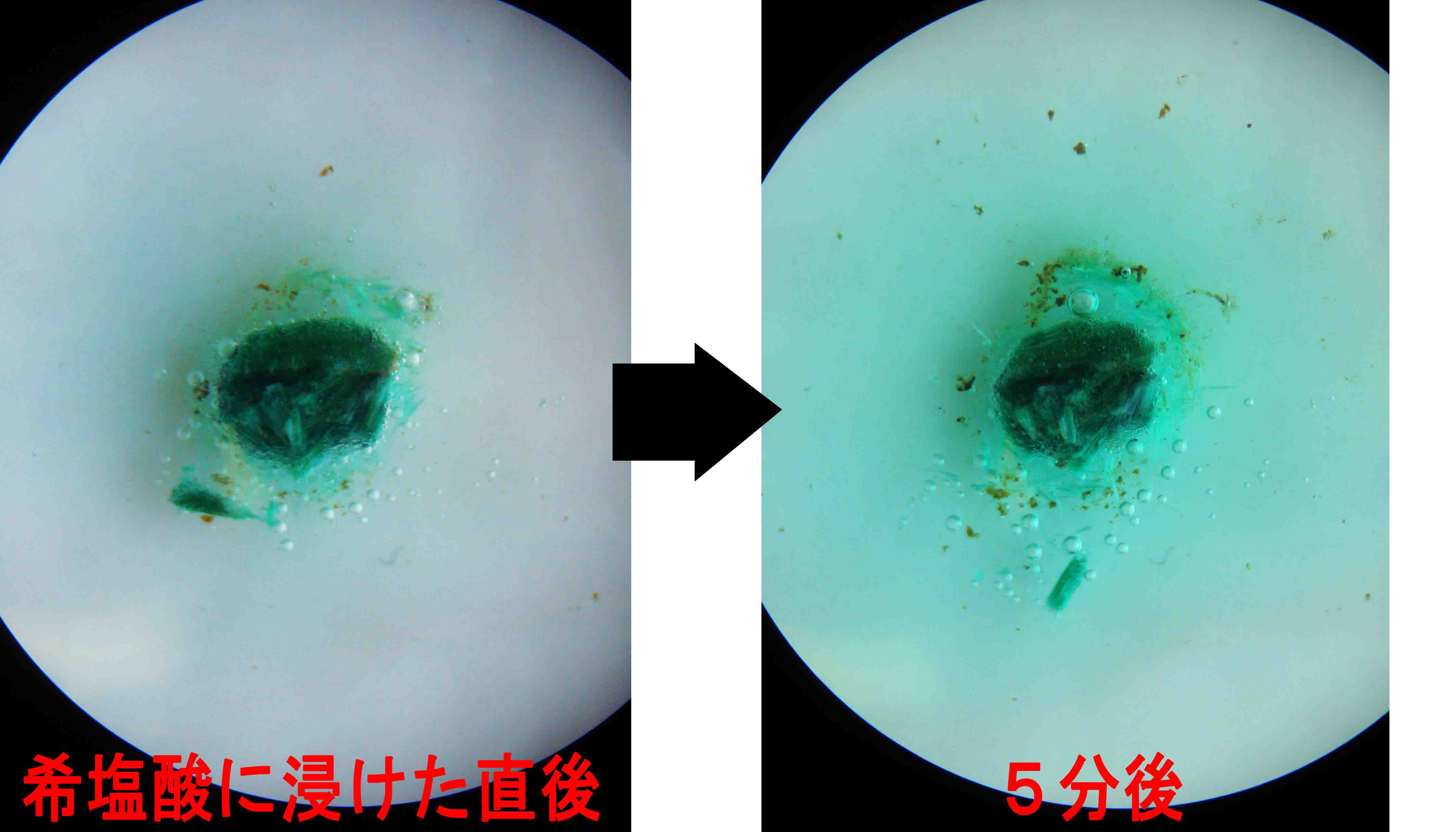
藍銅鉱(炭酸銅/Cu3(CO3)2(OH)2)の場合
Cu3(CO3)2(OH)2 + 6HCl → 3Cu2+ + 6Cl- + 4H2O + 2CO2↑
藍銅鉱 塩酸 塩化銅溶液(緑色) 水 二酸化炭素
(泡)
・おだやかに発泡しつつ,徐々に周囲が塩化銅の緑色溶液になっていく (※理科の化学実験で用いる塩化銅水溶液はこれに比べ濃度 が低いので青色である)。これは銅の炎色反応(緑)を示す。やや発泡が著しいほかは孔雀石の場合とあまり変わらな い。
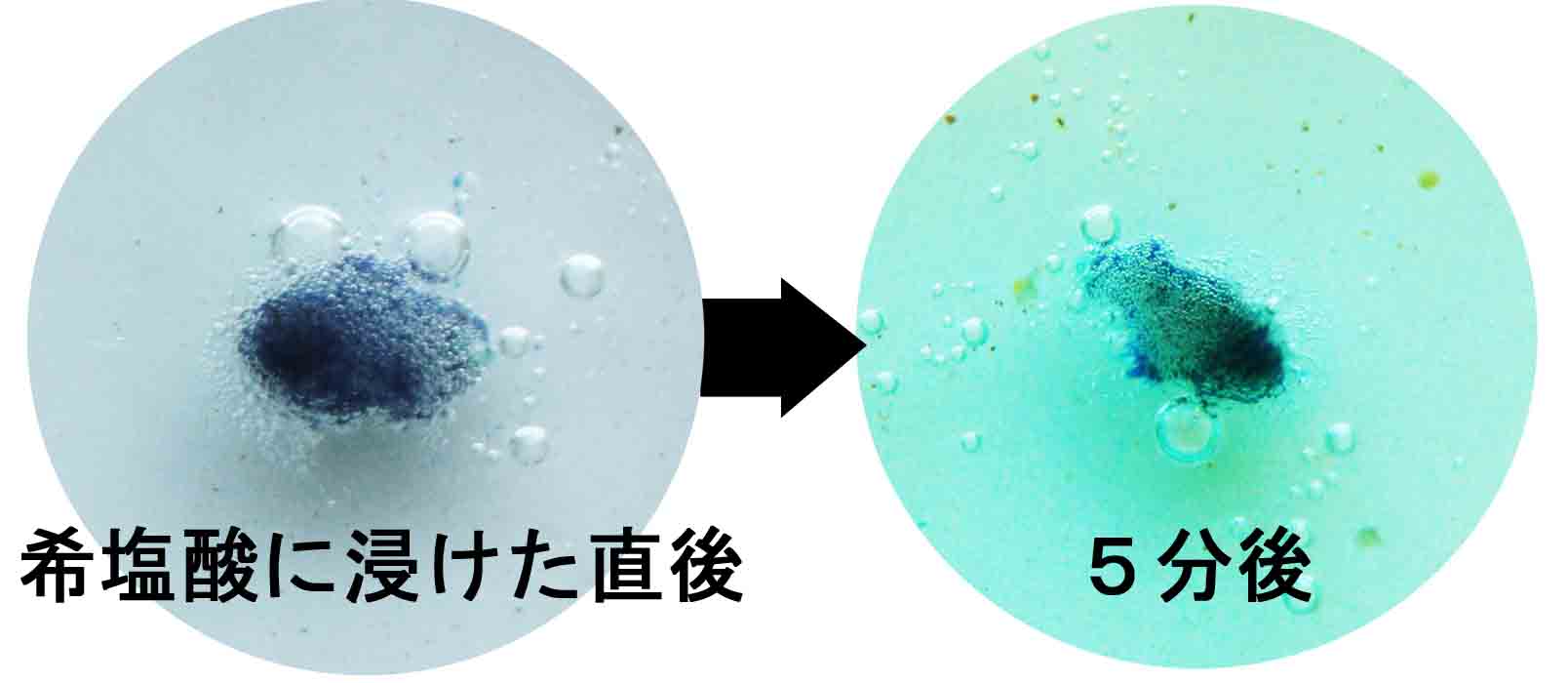
ブロシャン銅鉱(硫酸銅/Cu4(SO4)(OH)6)の場合

・泡を出さずにゆっくり溶け,徐々に周囲が緑色の銅の溶液になってい く。こ れは銅の炎色反応(緑)を示す。
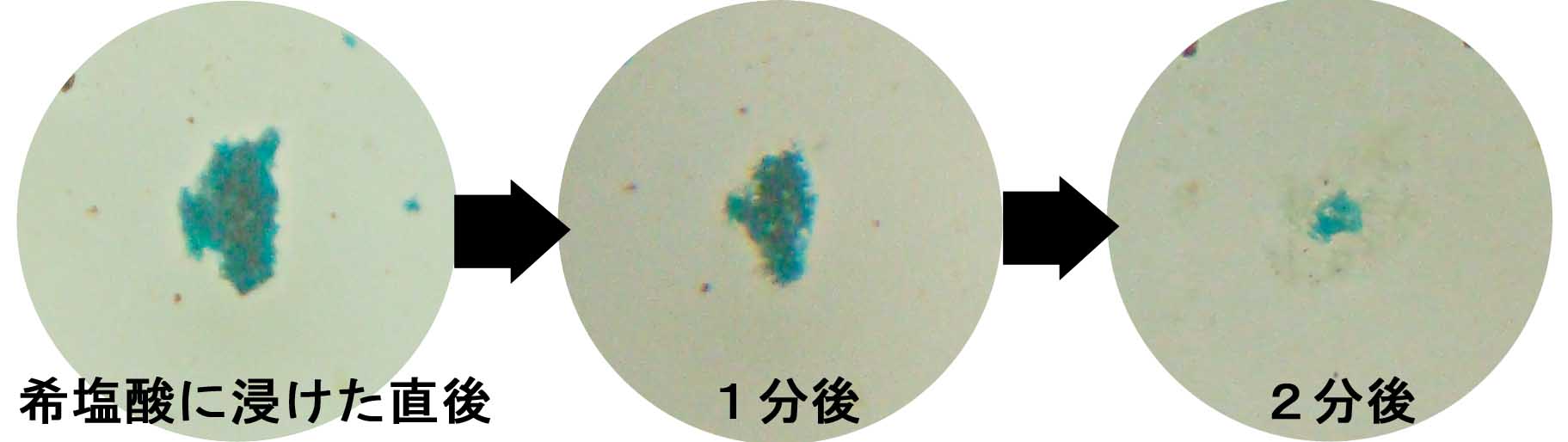
青鉛鉱(銅と鉛の硫酸塩/CuPb(SO4)(OH)2)の場合


・泡を出さずに徐々に塩化鉛(PbCl2)の白色不透明の厚い被膜に覆われていく。 銅はわずかずつ溶け出す。この塩化鉛は試験管に移 し,少量の水を加え,加熱すると溶けるが,冷えると再び白濁状で析出する。
閃亜鉛鉱(硫化亜鉛/ZnS)の場合
・ほとんど泡を出さずにゆっくり溶ける。塩酸は塩化亜鉛の溶液 となるが,もとの閃亜鉛鉱には鉄(2価)が0.数〜約20%含まれ,塩化鉄溶液(鉄 は酸化され,3価になる)との混合溶液となり,褐色がかる。また,イオウは硫化水素となるため,溶液は卵腐臭がする。
