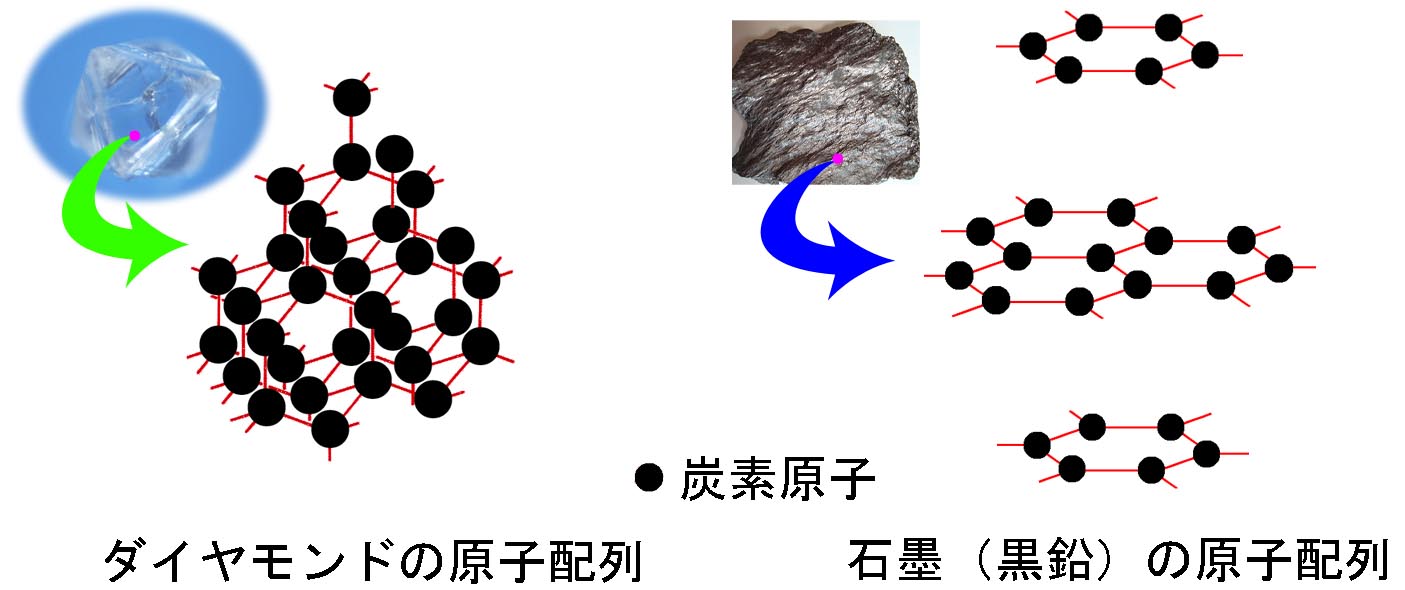
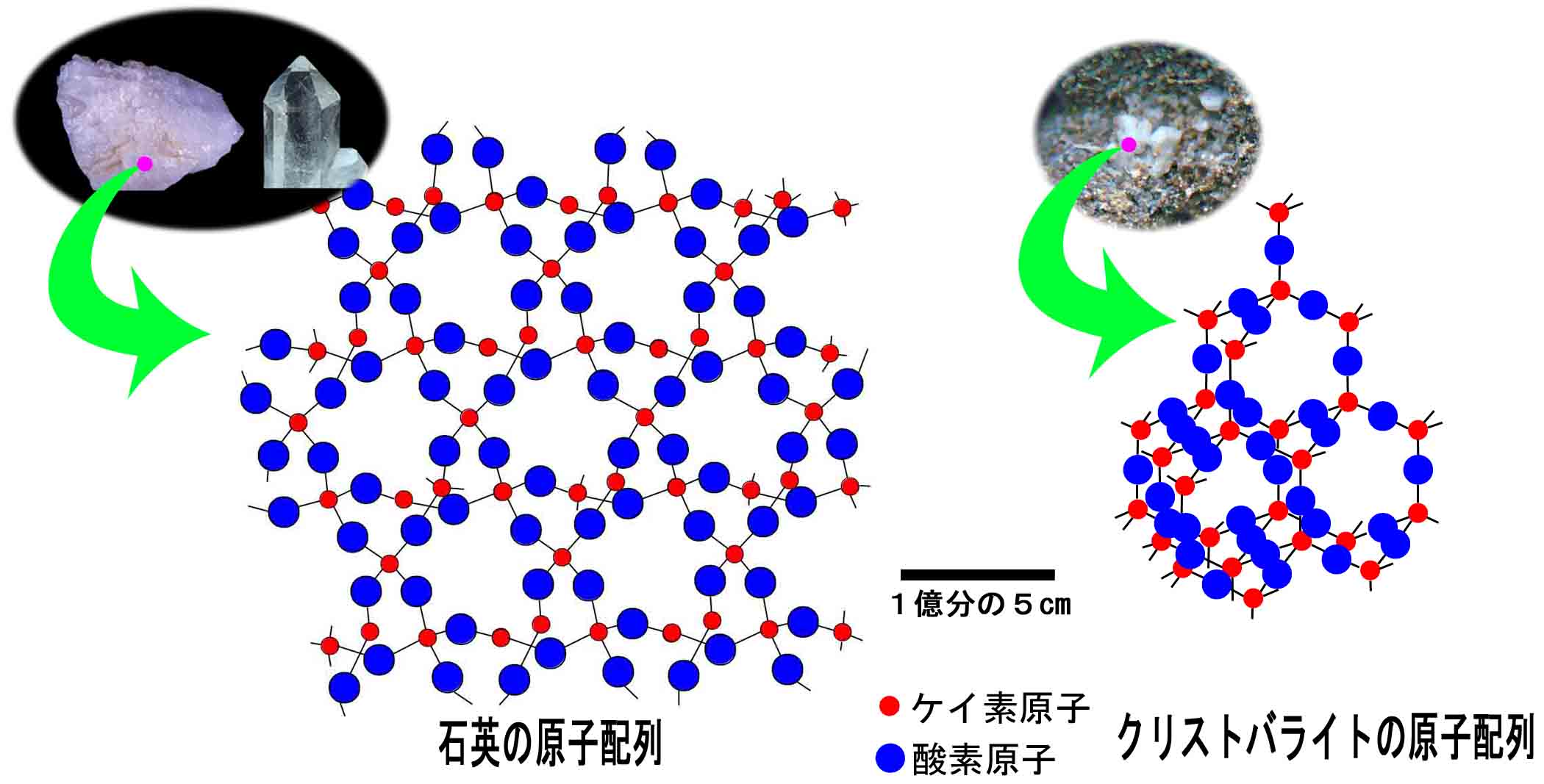
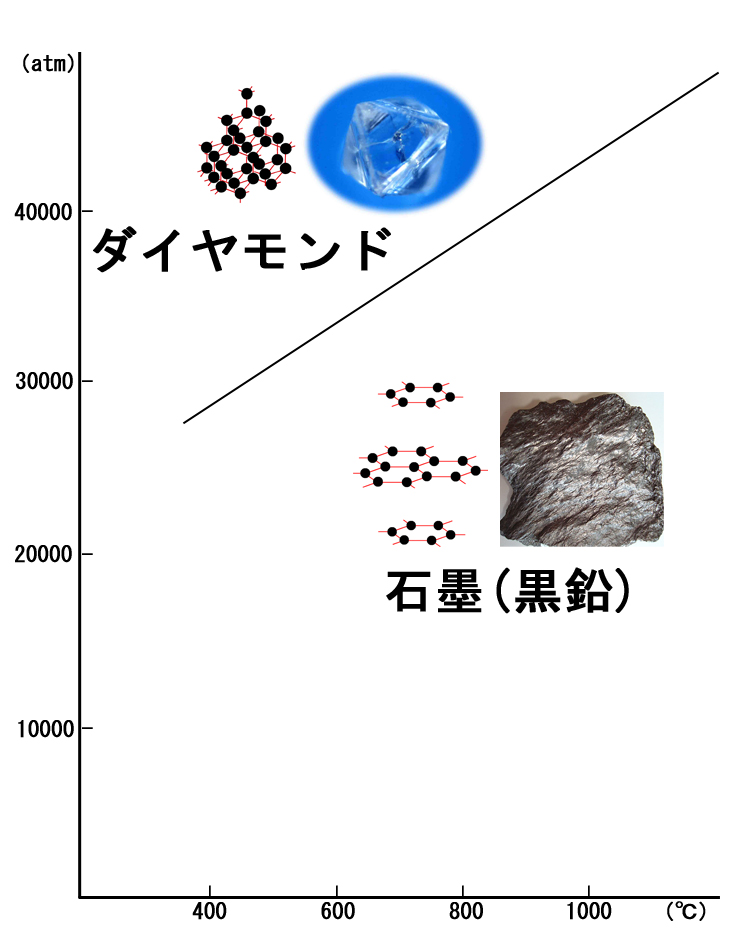
−原子配列が同じで原子の種類が異なる場合 (岩塩とカリ岩塩 同形(類質同像))−
塩化ナトリウム(NaCl)である岩塩(食塩)は,ナトリウム原子(Na+)
と
塩素原子(Cl−)が,個数の割合(原子比)で1:1で,下図のように配列してい
る
鉱物です。
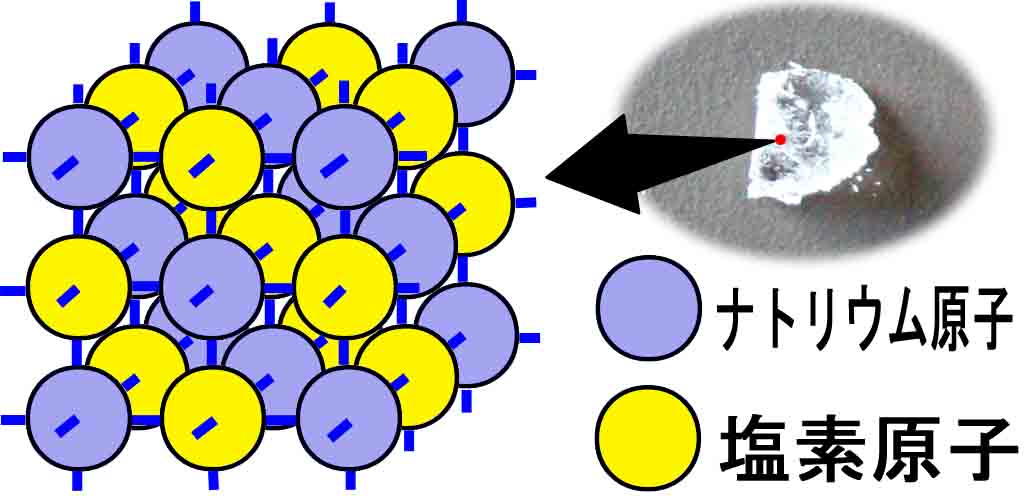
岩塩の原子配列
塩化カリウム(KCl)であるカリ岩塩は,カリウム原子(K+)と塩素原子
(Cl−)が,個数の割合(原子比)で1:1で,下図のように配列している鉱物で
す。
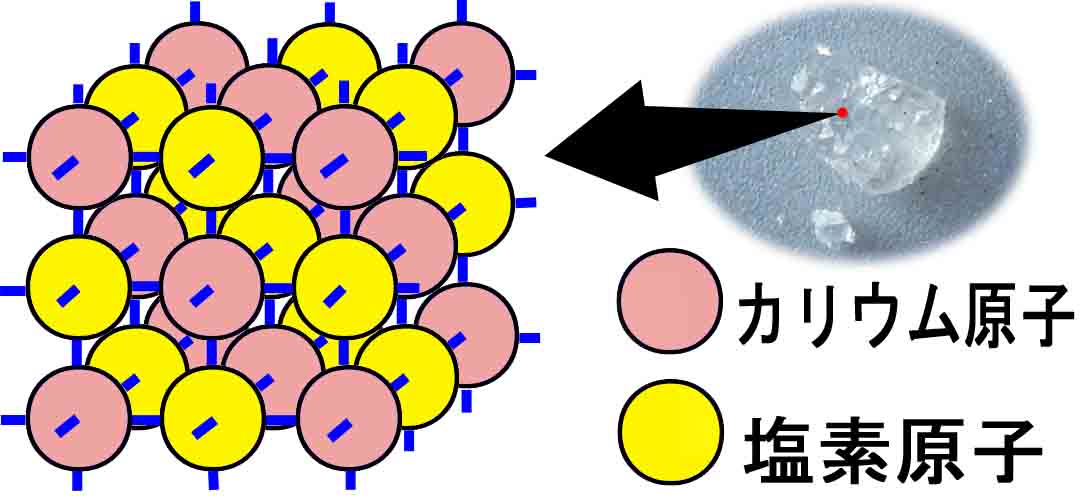
カリ岩塩の原子配列
なお,岩塩のナトリウム原子の代わりにカリウム原子が,逆にカリ岩塩のカリウム原子の代わりにナトリウム原子が入ることがあります(下 図)。このように原子配列が同じで原子の種類が入れ換わる現象を同形置換と いい,その同形置換がある結晶などを固溶体といいます(※ 固溶体には同形置換によるもの以外に,原子配列の隙間に別の原子が入り込む形式や構成原子の一部が欠損する形式などもあります。また,異種原子による置換 が進むと,原子配列が違ってくる固溶体もあります)。
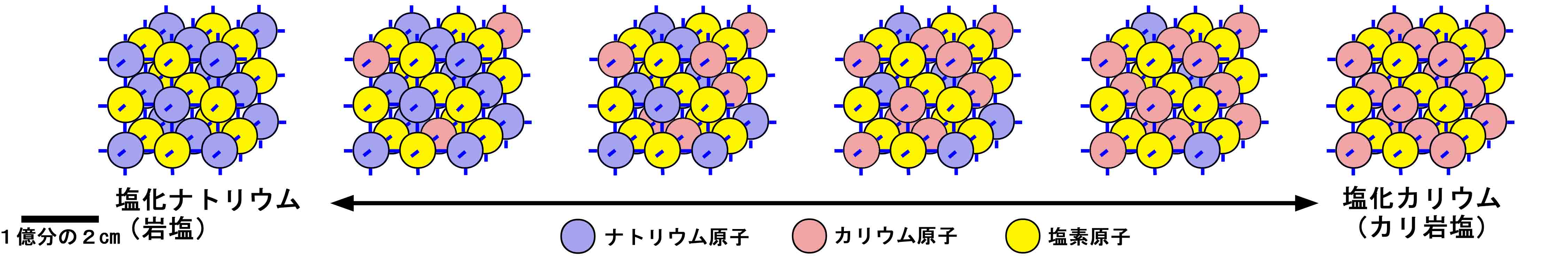
岩
塩とカリ岩塩との間で,ナトリウム原子とカリウム原子が同形置換で入れ替わってできる固溶体
岩塩のナトリウム原子の代わりにカリウム原子が入っていき,その数がナトリウム原子より多くなるとカリ岩塩になる。一般に,このような同形 置換は高温条件で あるほどよく起こる。また,大きさが似たもの同士,化学的性質 が似たもの(周期表の縦列の同じ族)同士の原子が同形置換を起こしやすい。
互いに同形の関係に ある鉱物はきわめて多く,
長石類(曹長石・カリ長石・灰長石など数種。下図),
ざ くろ石類(苦ばんざくろ石・鉄ばんざくろ石・満ばんざくろ石・灰ばんざくろ石・灰鉄ざくろ石・灰クロムざくろ石など10数種),
かんらん石類(苦土かんらん石・テフロ石(マンガンかんらん石)・鉄かんらん石など数種),
電気石類(リチア電気石・苦土電気石・鉄電気石など10数種),
単斜輝石類(透輝石,灰鉄輝石・普通輝石・ひすい輝石・リチア輝石など約10種),
単斜角せん石類(透せん石,アクチノせん石,普通角せん石,らんせん石など数10種)
などがよく知られ,その多くは固溶体をしなています。
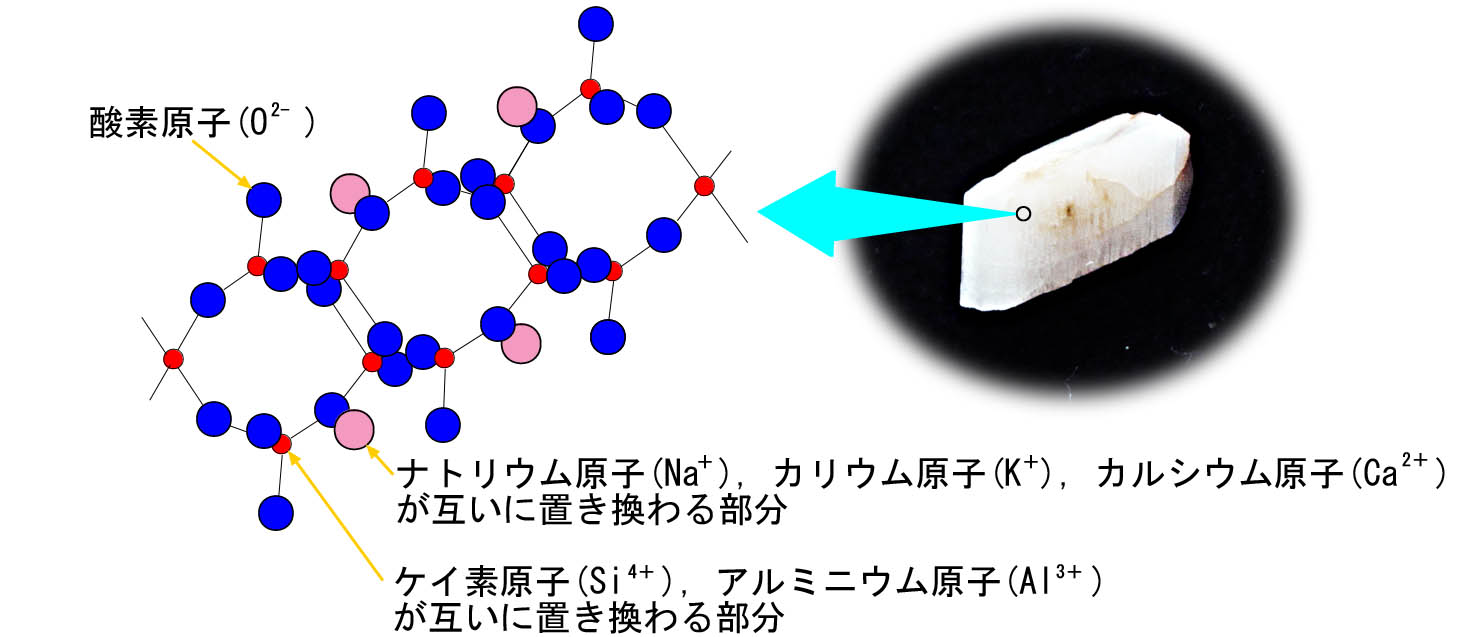
例1)同形置換が起こる長石類の原子配列
桃色の部分にナトリウム原子が多く入ると曹長石(アルバイト),カリウム原子が多く入るとカリ長石,カルシウム原子 が多く入ると灰長石(アノーサイト)になる。(※なお,カルシウム原子が多 く入ると+の電荷が増えるため,結晶全体の電荷が中性になるように,赤色の部分にケイ素原子より+の電荷が少ないアルミニウム原子が入りやすくなる)
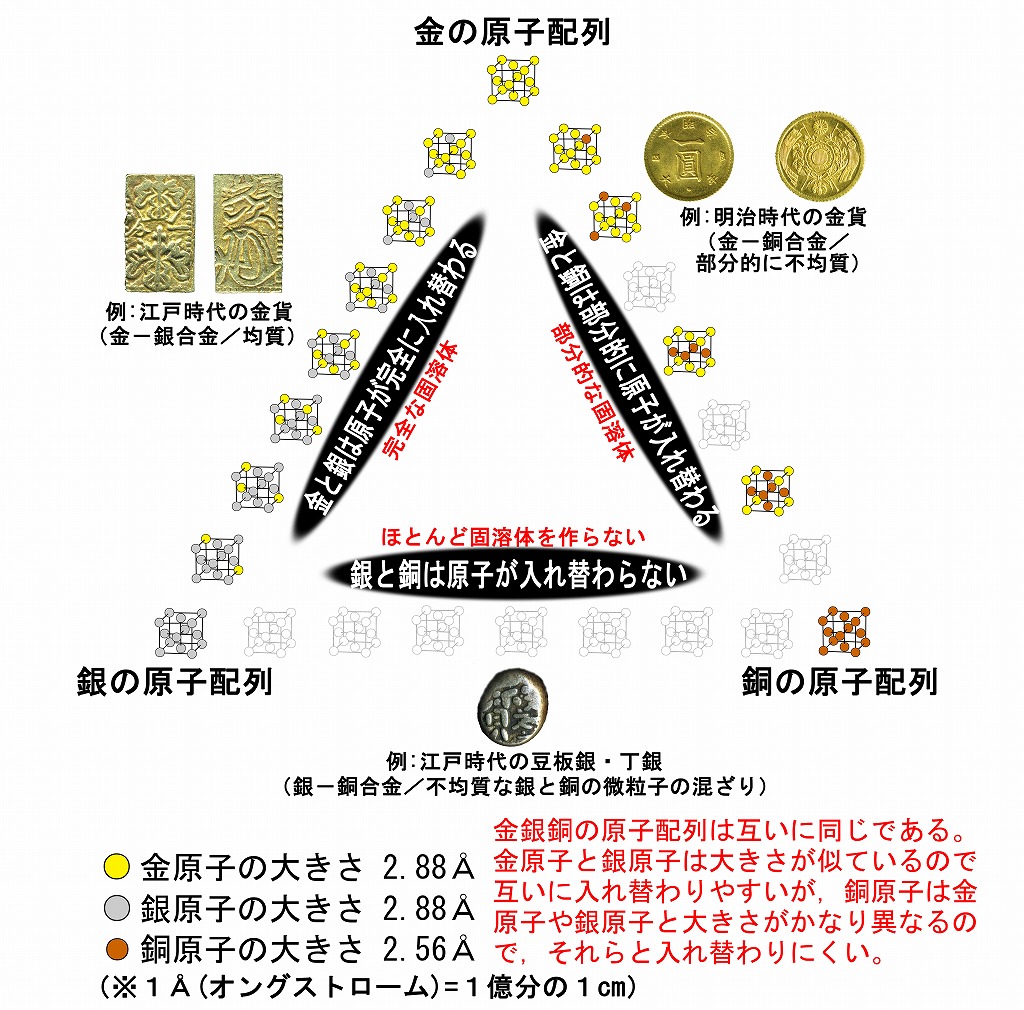
例2)同形置換が起こる金銀銅の原子配列
金属結晶である金銀銅は互いに同形の関係にあり(原子配列が同じ),金と銀は原子の大きさが似ているのであらゆる割合で入れ替わる(固溶しやすい)が,銅は金や銀と原子の大きさがかなり異なるのでそれらと入れ替わりにくい(固溶しにくい)。
なお,自然界から産出する金(自然金)の多くは金銀合金で,金と銀の幅広い組成の固溶体である。
桃色の部分にナトリウム原子が多く入ると曹長石(アルバイト),カリウム原子が多く入るとカリ長石,カルシウム原子 が多く入ると灰長石(アノーサイト)になる。(※なお,カルシウム原子が多 く入ると+の電荷が増えるため,結晶全体の電荷が中性になるように,赤色の部分にケイ素原子より+の電荷が少ないアルミニウム原子が入りやすくなる)

例2)同形置換が起こる金銀銅の原子配列
金属結晶である金銀銅は互いに同形の関係にあり(原子配列が同じ),金と銀は原子の大きさが似ているのであらゆる割合で入れ替わる(固溶しやすい)が,銅は金や銀と原子の大きさがかなり異なるのでそれらと入れ替わりにくい(固溶しにくい)。
なお,自然界から産出する金(自然金)の多くは金銀合金で,金と銀の幅広い組成の固溶体である。